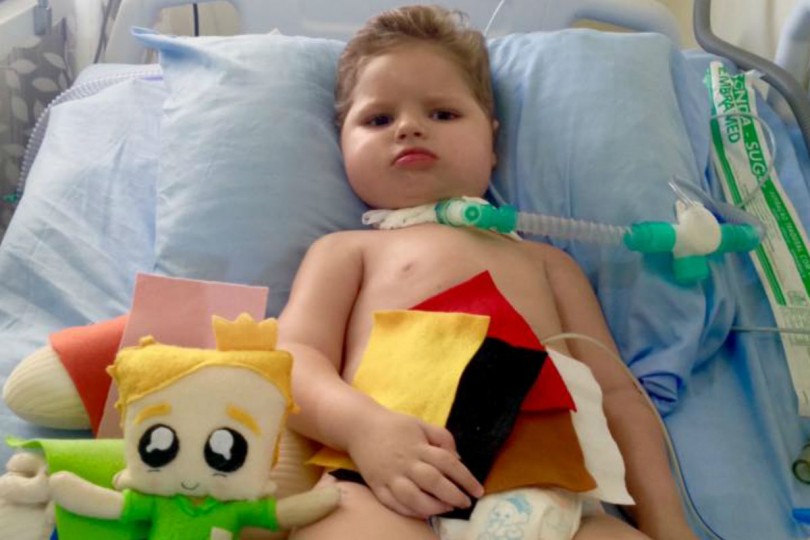
Uma luz no fim do túnel surgiu para a família do pequeno Bernardo Fantin Souza, 2 anos, morador da Lapa, na Região Metropolitana de Curitiba. Portador de uma doença rara, a Atrofia Muscular Espinhal (AME) do tipo 1, a mais severa de todas, ele conseguiu na Justiça uma liminar obrigando o Estado do Paraná a comprar o medicamento Spinraza (nusinersena) no prazo de 10 dias úteis, após o Estado receber a intimação.
A decisão (um mandado de segurança) é liminar e o Estado pode recorrer dela. No entanto, a família torce para que o Estado não recorra ou, se fizer isso, que a Justiça mantenha a obrigatoriedade de compra do medicamento, única esperança existente na medicina para conter o avanço da doença e até reverte-la em partes. A liminar foi dada na quarta-feira passada pela juíza Diele Denardin Zideck, da 5ª Vara da Fazenda Pública de Curitiba.
A advogada Adriana Pedrosa Lopes, que atua voluntariamente neste processo do Bernardo, já tinha ingressado com ação na Justiça Federal. Mas o juiz federal negou o fornecimento do Spinraza pela União, alegando não ter comprovações da eficácia do medicamento.
Nesta época, a Anvisa ainda não tinha autorizado a entrada do Spinraza no Brasil. Depois que a Anvisa liberou a comercialização do remédio por aqui – embora ele ainda não esteja disponível para venda, pois passa por processo de regulação de preço -, a advogada tentou argumentar com o juiz, sem sucesso.
Assim, decidiu entrar com o mesmo pedido, porém na Justiça Estadual, onde conseguiu o mandado de segurança para fornecimento do Spinraza. E as decisões dos juízes parecem caminhar de forma positiva para os portadores de AME no Brasil. Uma decisão da ministra Carmen Lúcia, do Superior Tribunal Federal (STF), obrigou o estado de Goiás a fornecer o Spinraza a um paciente morador daquele estado.
Remédio aprovado no Brasil
A conquista do mandado de segurança não foi a única alegria da família de Bernardo. No fim do mês passado, a Anvisa autorizou a entrada do Spinraza no Brasil, que ainda passa por processo de formação de preço, que é o procedimento que vai decidir qual o preço máximo que ele deverá ser comercializado nas farmácias.
Até então, a única forma de consegui-lo era importando dos Estados Unidos, ao custo de R$ 3 milhões, valor que a Biogen, laboratório que lançou o remédio, cobra pela exportação. E a família de Bernardo está empenhada em conseguir a quantia. De abril até agora, quando começaram a campanha, arrecadaram R$ 400 mil.
Se conseguirem que o Estado forneça o Spinraza, a quantia arrecadada será usada nas terapias complementares. Bernardo precisa ser estimulado com fisioterapia duas vezes ao dia, além de acompanhamento de fonoaudiólogo, neurologista e de equipamentos que o mantém vivo.

COMO AJUDAR O BERNARDO?
Facebook: Juntos pelo Bernardo – AME tipo 1
Depósito bancário em nome de:
Bernardo Fantin Souza
CPF 127.462.439-89
Banco Caixa Econômica Federal
Agência 0393
Operação 013
Conta poupança 16314-7
Banco Bradesco
Agência 0954-7
Conta poupança 1001904-4
Banco Itaú
Agência 3738
Conta poupança 25927-8 / 500
Vakinha online:
https://www.vakinha.com.br/vaquinha/ame-o-bernardo-fantin
Avanços na Itália
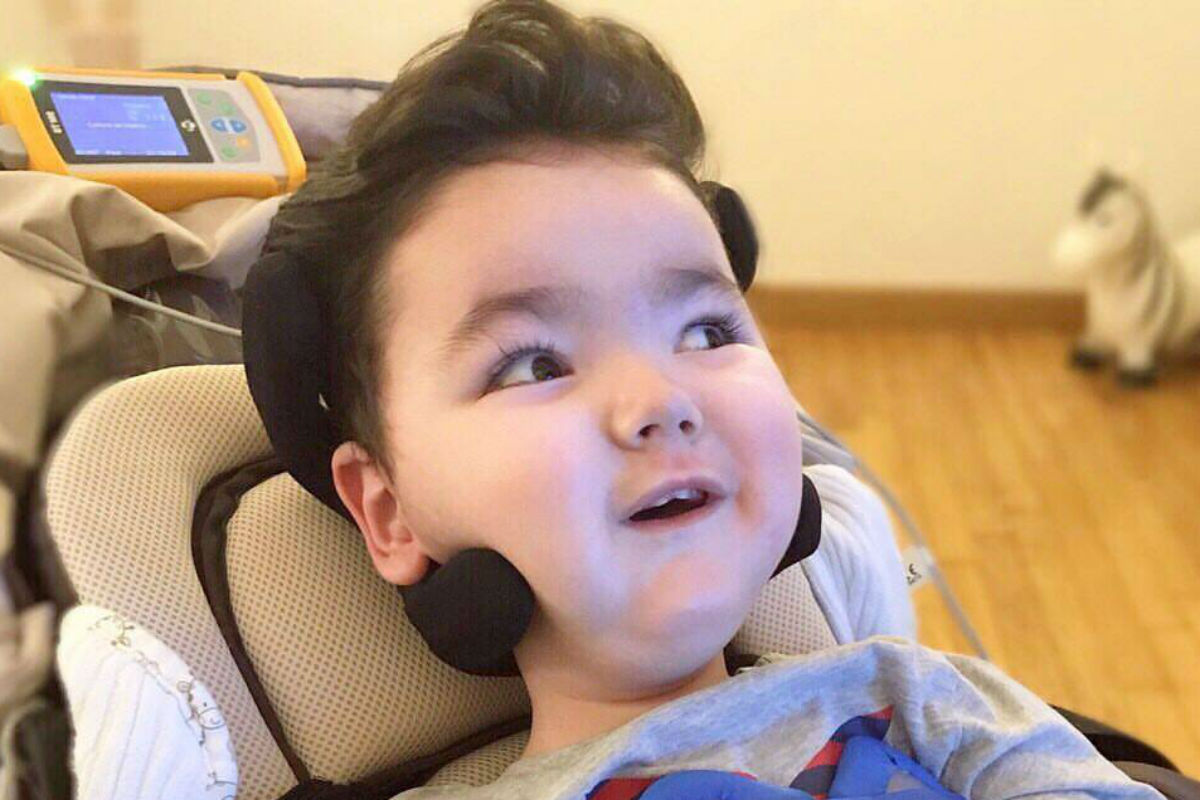
Além da importação, há ainda outra possibilidade de conseguir o Spinraza, ainda mais restrita. Pessoas que possuem cidadania italiana podem tentar incluir o paciente num programa de estudos italiano, que dá o medicamento de graça. A família do curitibaninho Arthur Tetto Lader, 2 anos, conseguiu. Mas, para isso, precisaram arrecadar R$ 1 milhão para custear a estadia deles na Itália, o internamento domiciliar, os médicos e o internamento hospitalar durante a aplicação do medicamento e todas as terapias complementares. E a viagem deles ocorreu no fim de abril, cheia de dificuldades e imprevistos, como a Tribuna mostrou.
Arthur está desde maio na Itália e já recebeu algumas doses do Spinraza, que somam um total de seis doses, dadas de dois em dois meses. A doença não permite ao paciente se mexer sozinho, sequer sentar, engolir ou mesmo respirar sem a ajuda de aparelhos. Com a aplicação do Spinraza, Arthur já consegue ficar algumas horas respirando sem aparelhos. E pode ser que possa sentar sozinho. No caso de Bernardo, o paciente da Lapa, existe a expectativa de que ele também respire sozinho e consiga pegar alguns objetos. Mas para isso, precisa da medicação. (GU)

COMO AJUDAR O ARTHUR?
Contas para depósito:
– Banco Itaú
Agência 0879
Conta 04256-2
CPF 036.769.629-07
Rafaella F. Tetto
– Banco do Brasil
Agência 3390-1
Conta 32.501-5
CPF 081.809.089-84
Robson Lader
Quanto vai custar aqui?
A Anvisa informou que não foi definido o valor que será cobrado pelo Spinraza no Brasil, porque o setor que define os preços máximos aguarda protocolo com as justificativas por parte da empresa Biogen. No Brasil, quem determina esses tetos de preços é a CMED, a câmara de regulação do mercado de medicamentos, cuja secretaria executiva está na Anvisa. Também compõem a CMED o Ministério da Saúde (que a preside), Casa Civil, Ministério da Fazenda, Ministério da Justiça e Ministério da Indústria, Comércio Exterior e Serviços.
A definição de preços-tetos passa por um processo complexo, pois envolve uma série de fatores nacionais e internacionais, para que o valor não fique desalinhado com os padrões internacionais. No Brasil, esse processo pode demorar até 90 dias, bem menos que na França, por exemplo, em que a média é de dois anos.
Vai ter no SUS?
A grande expectativa das famílias de pacientes com AME é a de que, além da entrada do medicamento no Brasil, o remédio e o tratamento sejam fornecidos via SUS. Quanto a isso, o Ministério da Saúde informou que só pode analisar a demanda após ser concluído o processo de formação de preço na Anvisa.
“Para a incorporação ao Sistema Único de Saúde (SUS), é necessário a apresentação de estudos à Comissão Nacional de Incorporação de Novas Tecnologias ao SUS (Conitec), que podem ser oriundos de empresas, organismos da sociedade civil e instituições participantes do SUS. Esses estudos exigem expertise, porém não são demorados nem caros. Assim se estabelecerá por meio do método científico e com transparência, quais os benefícios que se pode esperar de uma nova tecnologia, os novos riscos que poderá trazer aos pacientes e a que custo para o SUS. Até o momento, não houve apresentação de estudos para a incorporação do medicamento”, diz a nota do Ministério da Saúde.